锌指蛋白703通过反式激活CLDN4表达调控EMT,诱导肝癌患者sorafenib耐药
IF:5.959
期刊:Cell Death & Disease
合作单位:暨南大学
高通量检测方式:mRNAseq(中科普瑞提供测序及分析服务)
研究简介
转移是肝癌(HCC)死亡最常见的原因之一,然而HCC转移的分子机制尚不完全清楚。本研究首次报道了锌指蛋白703(ZNF703)在促进肝细胞癌转移中的作用。ZNF703通过上调CLDN4表达来调节上皮间充质转化(EMT),从而促进HCC转移和sorafenib耐药。ZNF703可能成为HCC治疗的潜在靶点和预测sorafenib药物敏感性的潜在生物标志物。
研究思路
a. 验证目标分子ZNF703在实验组及对照组中的表达,并联合临床表型分析
b. 体外及体内ZNF703功能验证
c. RNAseq进行调控机制预测,分子实验验证
d. 体外及体内CLDN4功能验证
e. 体外及体内药物敏感性检测
研究结果
01
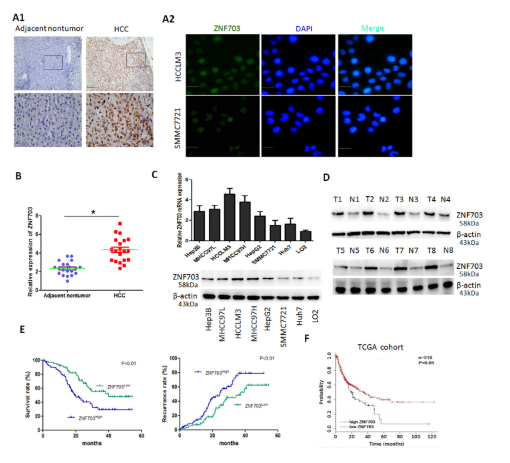
ZNF703在HCC组织中高表达,与患者预后不良有关
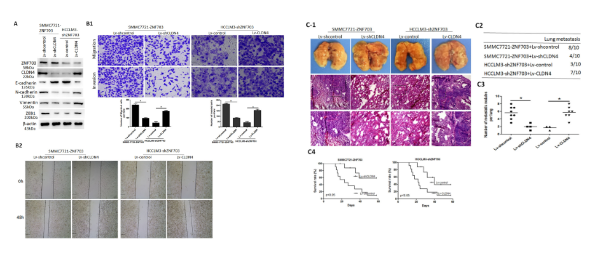
采用免疫组织化学(IHC)检测128对HCC癌及癌旁组织中ZNF703的表达。结果显示,与癌旁组织相比,ZNF703在HCC组织中高表达。分别利用western blot和qRT-PCR验证发现,HCC样品中ZNF703 mRNA和蛋白的表达明显更高。结合临床表征数据分析发现,ZNF703过表达也与预后不良有关,ZNF703高表达患者具有较短总生存期和较高的复发率。
02
ZNF703增强肝癌细胞的侵袭和转移能力
为了评估ZNF703在HCC转移中的作用,研究建立了ZNF703过表达细胞系和敲除细胞系。体外实验发现,过表达ZNF703显著增强了肝癌细胞的迁移和侵袭活性,敲降ZNF703结果与之相反。体内转移实验表明,ZNF703在肝癌细胞中过表达显著增加了转移率和肺转移结节的数量。同时,细胞中ZNF703的下调显著增加了异种移植小鼠的总生存时间。这些数据表明,ZNF703增强了HCC的侵袭和转移能力。

03
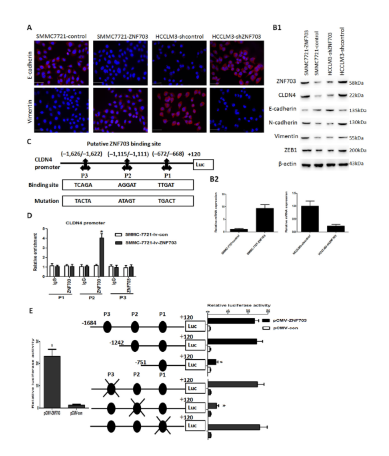
ZNF703通过激活肝癌细胞中CLDN4表达来诱导EMT
EMT在HCC转移中起重要作用。免疫荧光及Western blot结果表明,与对照组相比,ZNF703的过表达降低了E-cadherin,上调了vimentin的表达,提示ZNF703可诱导肝癌细胞发生EMT。为了进一步探讨ZNF703影响肝癌转移和侵袭的分子机制,利用RNA测序分析mRNA表达谱差异,发现了ZNF703过表达增加CLDN4的表达,敲降下调CLDN4表达。最终,生物信息学分析结合荧光素酶报告及ChIP实验确定了CLDN4是ZNF 703的直接作用靶点。
04
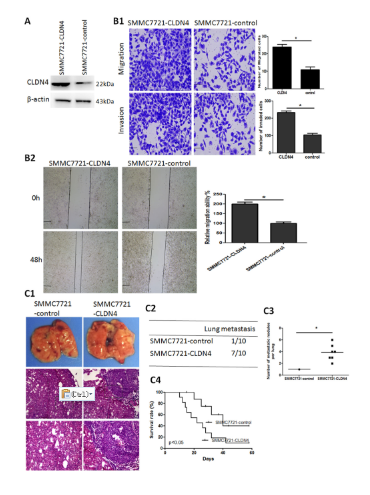
CLDN4过表达促进HCC的侵袭和转移
通过体外细胞实验及体内裸鼠成瘤模型,研究CLDN4在HCC细胞中的作用。结果表明,CLDN4过表达可促进HCC的侵袭和转移。
05
CLDN4对于ZNF703介导的HCC的侵袭和转移至关重要
通过下调CLDN4表达看是否可逆转ZNF703过表达引起的EMT上调,验证CLDN4是否参与了ZNF703介导的HCC侵袭和转移。CLDN4的过表达恢复了ZNF703沉默引起的迁移和侵袭力的降低,而CLDN4的敲低则减弱了ZNF703促进的迁移和侵袭力。由此得出,ZNF703通过激活肝癌细胞中CLDN4的表达来诱导EMT。
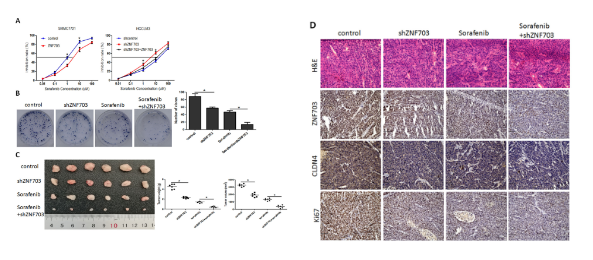
06
ZNF703在HCC中的表达与sorafenib的药物敏感性有关
菌落形成实验显示,sorafenib可显著降低肝癌细胞的增殖。此外,体内抗肿瘤实验表明, shZNF703+sorafenib组的肿瘤负荷显著下降,这表明ZNF703的敲降增强了sorafenib对皮下肿瘤生长的影响。免疫组化结果与体内结果一致。